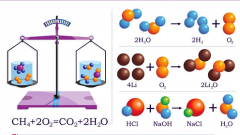
Прежде чем дать определение окислительно-восстановительным реакциям, необходимо ввести некоторые понятия. Первое из них - степень окисления. Это условный заряд, которым обладает каждый атом вещества. При суммировании степеней окисления всех атомов должен получиться нуль. Таким образом можно найти степень окисления любого атома, которое может принимать разные значения.
Окисление - это процесс отдачи электронов атомом, а восстановление - присоединение электронов. Окислителем называется любое вещество, которое способно принимать электроны (восстанавливаться). Восстановителем называется любое вещество, способное отдавать электроны (окисляться).
Окислительно-восстановительные реакции приводят к изменению степеней окисления атомов веществ, которые вступают в реакцию. Окисление вызывает повышение степени окисления, а восстановление - понижение. В неорганической химии подобные процессы можно рассматривать как перемещение электрона от восстановителя к окислителю.
Существует несколько видов окислительно-восстановительных реакций:
1. В межмолекулярных реакциях атомы, меняющие степени окисления, находятся в одном и том же веществе. В пример можно привести реакцию получения серного газа из двуокиси серы.
2. Во внутримолекулярных реакциях атомы, меняющие степени окисления, находятся в разных веществах. Например: реакция разложения дихромата аммония.
3. Самоокисление или самовосстановление. В таких реакциях окислителем и восстановителем служит одно вещество.
Почти во всех уравнениях окислительно-восстановительных очень сложно подобрать коэффициенты, чтобы уравнять левую и правую часть. Для этого был изобретен простой и изящный метод электронного баланса. Суть его заключается в том, что количество отданных электронов всегда равно количеству принятых.
Пусть дана реакция получения оксида алюминия. Для начала необходимо правильно определить степени окисления атомов веществ в правой и левой части уравнения. Степени окисления кислорода и алюминия изменились. Подсчитайте количество электронов, которое отдал алюминий. Оно должно равняться числу электронов, которое принял кислород. Необходимо составить два уравнения и поставить нужные коэффициенты, чтобы они превратились в тождества. Эти коэффициенты и нужно подставить в исходное уравнение при соответствующих атомах.
Окисление - это процесс отдачи электронов атомом, а восстановление - присоединение электронов. Окислителем называется любое вещество, которое способно принимать электроны (восстанавливаться). Восстановителем называется любое вещество, способное отдавать электроны (окисляться).
Какие реакции относятся к окислительно-восстановительным?
Существует несколько видов окислительно-восстановительных реакций:
1. В межмолекулярных реакциях атомы, меняющие степени окисления, находятся в одном и том же веществе. В пример можно привести реакцию получения серного газа из двуокиси серы.
2. Во внутримолекулярных реакциях атомы, меняющие степени окисления, находятся в разных веществах. Например: реакция разложения дихромата аммония.
3. Самоокисление или самовосстановление. В таких реакциях окислителем и восстановителем служит одно вещество.
Метод электронного баланса
Почти во всех уравнениях окислительно-восстановительных очень сложно подобрать коэффициенты, чтобы уравнять левую и правую часть. Для этого был изобретен простой и изящный метод электронного баланса. Суть его заключается в том, что количество отданных электронов всегда равно количеству принятых.
Пусть дана реакция получения оксида алюминия. Для начала необходимо правильно определить степени окисления атомов веществ в правой и левой части уравнения. Степени окисления кислорода и алюминия изменились. Подсчитайте количество электронов, которое отдал алюминий. Оно должно равняться числу электронов, которое принял кислород. Необходимо составить два уравнения и поставить нужные коэффициенты, чтобы они превратились в тождества. Эти коэффициенты и нужно подставить в исходное уравнение при соответствующих атомах.
Видео по теме
Источники:
- Окислительно-восстановительные реакции
- Окислительно-восстановительные реакции