Вам понадобится
- атомный номер элемента, изотопы
Инструкция
1
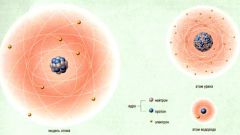
В отличие от протонов, нейтроны не имеют электрического заряда, то есть их электрический заряд равен нулю. Поэтому, зная атомный номер элемента, нельзя однозначно сказать, сколько нейтронов содержится в его ядре. К примеру в ядре атома углерода всегда содержится 6 протонов, однако протонов в нем может быть 6 и 7. Разновидности ядер химического элемента с разным количеством нейтронов в ядре называются изотопами этого элемента. Изотопы могут быть как природными, так и полученными искусственно.
2
Атомные ядра обозначаются буквенным символом химического элемента из таблицы Менделеева. Справа от символа вверху и внизу стоят два числа. Верхнее число A - это массовое число атома, A = Z+N, где Z - заряд ядра (число протонов),а N - число нейтронов. Нижнее число - это Z - заряд ядра. Такая запись дает информацию о количестве нейтронов в ядре. Очевидно, оно равно N = A-Z.
3
У разных изотопов одного химического элемента число A меняется, что отражено в записи этого изотопа. Определенные изотопы имеют свои оригинальные названия. Например, обычное ядро водорода не имеет нейтронов и имеет один протон. Изотоп водорода дейтерий имеет один нейтрон (A = 2), а изотоп тритий - два нейтрона (A = 3).
4
Зависимость числа нейтронов от числа протонов отражена на N-Z диаграмме атомных ядер. Устойчивость ядер зависит от отношения числа нейтронов и числа протонов. Ядра легких нуклидов наиболее устойчивы при N/Z = 1, то есть при равенстве количества нейтронов и протонов. С ростом массового числа область устойчивости сдвигается к величинам N/Z>1, достигая величины N/Z ~ 1,5 для наиболее тяжелых ядер.
Видео по теме
Источники:
- Строение атомного ядра