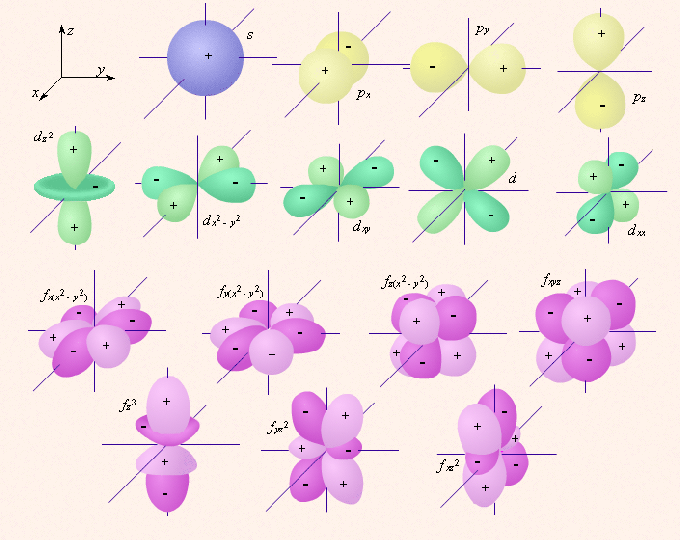Инструкция
1
Главным квантовым числом считается квантовое число электрона. Его значение показывает энергию электрона (например, в атоме водорода или в одноэлектронных системах). При этом энергия электрона вычисляется по формуле:
E = -13,6/(n^2) эВ.
N здесь принимает только натуральные значения.
E = -13,6/(n^2) эВ.
N здесь принимает только натуральные значения.
2
Электроны могут образовывать так называемый электронный уровень или электронную оболочку, если в многоэлектронных уровнях существуют электроны с одинаковым значение n. Уровни в этом случае принимают значение A, B, C… и так далее, соответствуя квантовому числу n=3, 2, 1… Квантовое значение, зная, на каком уровне находится электрон, не сложно. Максимальное же число электронов на уровне напрямую зависит от числа n – 2*(n^2).
3
Энергетический или электронный уровень – это набор электрона в стационарном состоянии. Главное ж квантовое число показывает удаленность от ядра.
4
Квантовое орбитальное число 2 может принимать значения от 0 до n-2, характеризуя форму орбиталей. Также оно характеризует подоболочку, на которой электрон и расположен. Квантовое число 2 имеет и буквенное обозначение. Квантовым числам 2 = 0, 1, 2, 3, 4 соответствуют обозначения 2 = s, p, d, f, g... Буквенные обозначения в записи, обозначающей электронную конфигурацию химического элемента, также присутствуют. По ним определяется квантовое число. Так, на подоболочке может быть до 2*(2l+1) электронов.
5
Магнитным называется квантовое число ml, при этом, l дописано снизу, как индекс. Его данные показывают атомную орбиталь, принимая значения от 1 до -1. Всего (21+1) значение.
6
Электрон будет являться фермионом, имея полуцелый спин, который равен ½. Его квантовое число будет принимать два значение, именно: ½ и –½. А также составлять две проекции электрона на ось и считаться квантовым числом ms.
Видео по теме