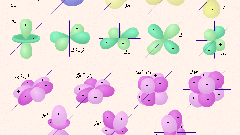Инструкция
1
Посмотрите на ячейку элемента в таблице Менделеева. Порядковый номер указывает заряд ядра атома этого элемента, а также число электронов в атоме, поскольку в основном состоянии атом электрически нейтрален. Как правило, порядковый номер пишется сверху слева от наименования элемента. Это целое число, не путайте его с массовым числом элемента.
2
Сначала электроны заполняют первый энергетический уровень, содержащий только 1s-подуровень. s-подуровень может содержать не больше двух электронов, причем они должны отличаться направлениями спина. Квантовую ячейку изобразите с помощью прямоугольника или небольшого отрезка. В ячейку поместите две разнонаправленные стрелки – смотрящую вверх и вниз. Так вы символически обозначили два электрона на s-подуровне первого энергетического уровня.
3
Второй энергетический уровень содержит одну ячейку s-подуровня и три ячейки p-подуровня. На p-орбитали может находиться до шести электронов. Эти три ячейки заполняются последовательно: сначала по одному электрону в каждой, затем еще по одному. Согласно правилу Гунда, электроны располагаются так, чтобы суммарный спин был максимальным.
4
Третий энергетический уровень заполняется, начиная с натрия, имеющего 11 электронов. Существует подуровень 3d, но он будет заполняться электронами только после ячейки 4s. Такое поведение электронов объясняется принципом наименьшей энергии: каждый электрон стремиться к такому расположению в атоме, чтобы его энергия была минимальной. А энергия электрона на подуровне 4s меньше, чем на 3d.
5
Вообще, заполнение электронами энергетических уровней происходит в такой последовательности: 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d. При этом на любой s-оболочке может находиться не больше двух электронов (одна орбиталь), на p-оболочке – не больше шести электронов (три орбитали), на d-подуровне – не более 10 (пять орбиталей), на f-подуровне – не более 14 (семь орбиталей).
Обратите внимание
В возбужденном состоянии атома электроны могут «перескакивать» из одной ячейки в другую, увеличивая, тем самым, валентность элемента. При образовании связей электрону энергетически выгодно переходить с заполненной s-орбитали на свободную p-орбиталь в пределах одного энергетического уровня.
Источники:
- «Начала химии», Н.Е. Кузьменко, В.В. Еремин, В.А. Попков, 2008