Инструкция
1
2
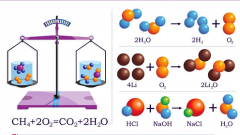
На скорость протекания химической реакции влияют три основных фактора: концентрация реагирующих веществ, температура, присутствие катализатора. Но решающее влияние на скорость оказывает природа реагентов. К примеру, при комнатной температуре реакция водорода с фтором идет очень интенсивно, а водород с йодом реагирует медленно даже при нагревании.
3
Зависимость между молярными концентрациями и скоростью реакции количественно описывается законом действующих масс. При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагентов: v=k•[A]^v(a)•[B]^v(B). Здесь k, v(A) и v(B) – константы.
4
Закон действующих масс справедлив для жидких и газообразных веществ (гомогенных систем), но не справедлив для твердых (гетерогенных). Скорость гетерогенной реакции зависит еще и от поверхности соприкосновения веществ. Увеличение поверхности повышает скорость реакции.
5
В общем виде закон действующих масс выглядит так: v(T)=k(T)•[A]^v(A)•[B]^v(B), где v(T) и k(T) – функции температуры. В таком виде закон позволяет рассчитать скорость реакции при изменяющейся температуре.
6
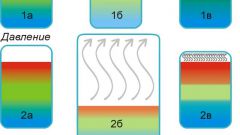
Чтобы приближенно оценить, как изменится скорость реакции при изменении температуры на ΔT, можно использовать температурный коэффициент Вант-Гоффа γ. Как правило, скорость гомогенной реакции увеличивается в 2-4 раза при повышении температуры на 10˚, т.е. γ=k(T+10)/k(T)≈2÷4.
Видео по теме
Источники:
- «Начала химии», Н.Е. Кузьменко, В.В. Еремин, В.А. Попков, 2008.