Вам понадобится
- - ручка;
- - бумага для записей;
- - периодическая система элементов (таблица Менделеева).
Инструкция
1
2
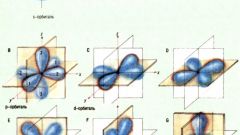
Структуру электронных оболочек выражают с помощью графических электронных формул. Для записи формулы используйте матрицу. В одной ячейке могут располагаться один или два электрона с противоположными спинами. Электроны изображаются стрелками. Матрица наглядно показывает, что на s-орбитали могут располагаться два электрона, на p-орбитали – 6, на d – 10, на f -14.
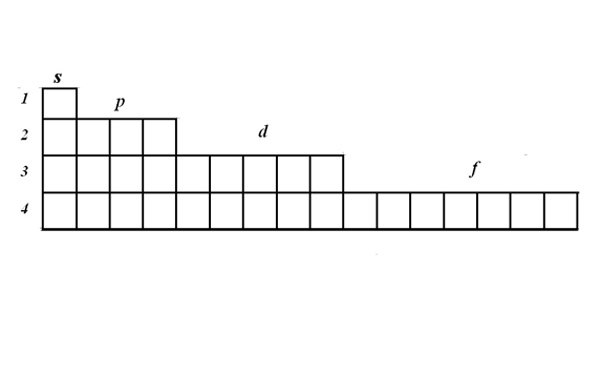
3
4
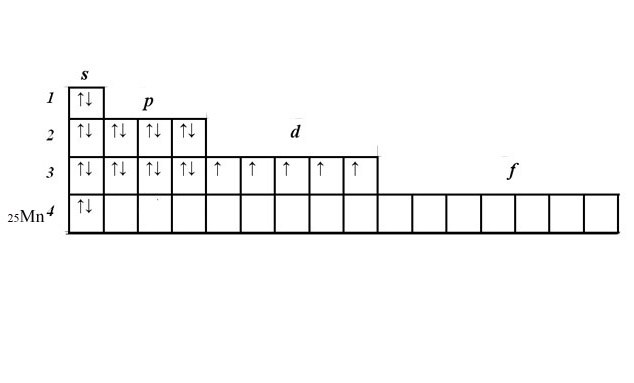
Запишите порядковый номер и символ элемента рядом с матрицей. В соответствии со шкалой энергии заполоните последовательно 1s, 2s, 2p, 3s, 3p, 4s уровни, вписав по два электрона в ячейку. Получится 2+2+6+2+6+2=20 электронов. Эти уровни заполнены полностью.
5
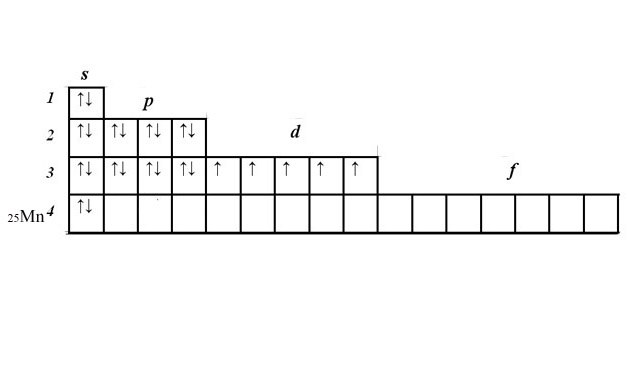
У вас осталось еще пять электронов и незаполненный 3d-уровень. Расположите электроны в ячейках d-подуровня, начиная слева. Электроны с одинаковыми спинами расположите в ячейках сначала по одному. Если все ячейки заполнены, начиная слева, добавьте по второму электрону с противоположным спином. У марганца пять d-электронов, расположенных по одному в каждой ячейке.
6
Электронно-графические формулы наглядно показывают количество неспаренных электронов, которые определяют валентность.
Обратите внимание
Помните, что химия – наука исключений. У атомов побочных подгрупп Периодической системы встречается «проскок» электрона. Например, у хрома с порядковым номером 24 один из электронов с 4s-уровня переходит в ячейку d-уровня. Похожий эффект есть у молибдена, ниобия и др. Кроме того, есть понятие возбужденного состояния атома, когда спаренные электроны распариваются и переходят на соседние орбитали. Поэтому при составлении электронно-графических формул элементов пятого и последующих периодов побочной подгруппы сверяйтесь со справочником.
Источники:
- как составить электронную формулу химического элемента