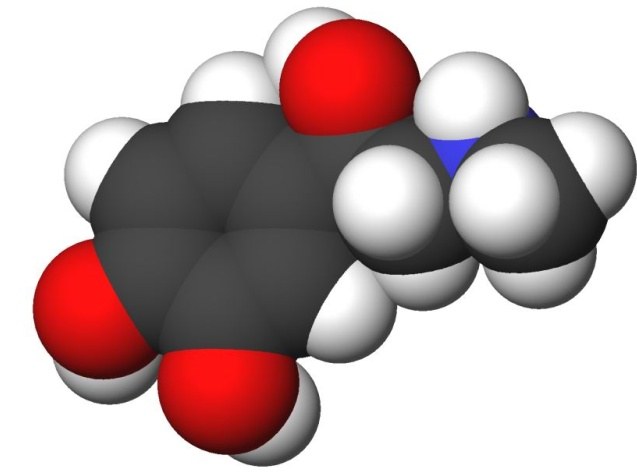
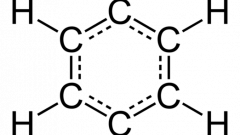
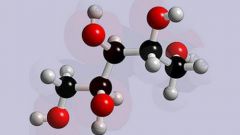
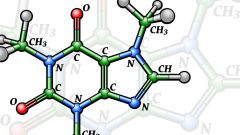
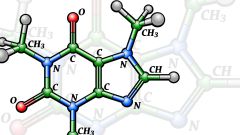
Впервые эта теория была выдвинута знаменитым русским химиком А.М. Бутлеровым в 1861-м году, в его докладе «О химическом строении веществ». Ее основные положения можно вкратце описать следующим образом:
- атомы, входящие в состав органических молекул, соединяются не в хаотичном, а в строго определенном порядке, согласно их валентности;
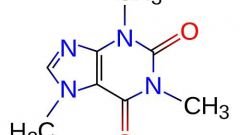
- свойства органических молекул зависят не только от природы и числа входящих в них атомов, но и от химического строения молекул;
- каждая формула органической молекулы соответствует определенному количеству изомеров;
- каждая формула органической молекулы дает представление о ее физико-химических свойствах;
- во всех органических молекулах существует взаимное воздействие атомов, причем как связанных друг с другом, так и не связанных.
Для того времени выдвинутая Бутлеровым теория явилась настоящим прорывом. Она позволила ясно и четко объяснить многие моменты, остававшиеся непонятными, а также дала возможность определить пространственное расположение атомов в молекуле. Правильность теории была неоднократно подтверждена самим Бутлеровым, который синтезировал большое количество органических соединений, прежде неизвестных, а также рядом других ученых (например, Кекуле, выдвинувшем предположение о структуре бензольного «кольца») Что, в свою очередь, способствовало быстрому развитию органической химии, прежде всего, в ее прикладном значении – химической промышленности.
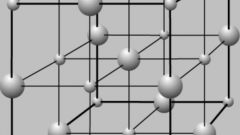
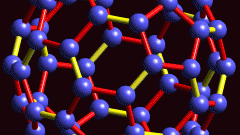
Развивая теорию Бутлерова, Я. Вант-Гофф и Ж. Ле Бель предположили, что четыре валентности углерода имеют четкую пространственную ориентацию (сам атом углерода расположен в центре тетраэдра, а его валентные связи как бы «направлены» к вершинам этой фигуры). На основе этого предположения был создан новый раздел органической химии — стереохимия.
Теория химического строения, разумеется, в конце 19-го века не могла объяснить физико-химическую природу взаимного влияния атомов. Это удалось сделать только в первой половине 20-го века, после открытия структуры атома и введению понятия «электронная плотность». Именно смещением электронной плотности и объясняется взаимное влияние атомов друг на друга.
- атомы, входящие в состав органических молекул, соединяются не в хаотичном, а в строго определенном порядке, согласно их валентности;
- свойства органических молекул зависят не только от природы и числа входящих в них атомов, но и от химического строения молекул;
- каждая формула органической молекулы дает представление о ее физико-химических свойствах;
- во всех органических молекулах существует взаимное воздействие атомов, причем как связанных друг с другом, так и не связанных.
Для того времени выдвинутая Бутлеровым теория явилась настоящим прорывом. Она позволила ясно и четко объяснить многие моменты, остававшиеся непонятными, а также дала возможность определить пространственное расположение атомов в молекуле. Правильность теории была неоднократно подтверждена самим Бутлеровым, который синтезировал большое количество органических соединений, прежде неизвестных, а также рядом других ученых (например, Кекуле, выдвинувшем предположение о структуре бензольного «кольца») Что, в свою очередь, способствовало быстрому развитию органической химии, прежде всего, в ее прикладном значении – химической промышленности.
Развивая теорию Бутлерова, Я. Вант-Гофф и Ж. Ле Бель предположили, что четыре валентности углерода имеют четкую пространственную ориентацию (сам атом углерода расположен в центре тетраэдра, а его валентные связи как бы «направлены» к вершинам этой фигуры). На основе этого предположения был создан новый раздел органической химии — стереохимия.
Теория химического строения, разумеется, в конце 19-го века не могла объяснить физико-химическую природу взаимного влияния атомов. Это удалось сделать только в первой половине 20-го века, после открытия структуры атома и введению понятия «электронная плотность». Именно смещением электронной плотности и объясняется взаимное влияние атомов друг на друга.
Видео по теме