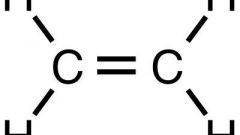Инструкция
1
2
В настоящее время более перспективным и экономически обоснованным признан второй способ. Реакция протекает таким образом:
С2Н6 + Cl2 = C2H5Cl + HCl
С2Н6 + Cl2 = C2H5Cl + HCl
3
4
Под действием света молекула хлора распадается на радикалы. Эти радикалы тут же вступают во взаимодействие с молекулами этана, забирая у них атом водорода, в результате этого образуются этильные радикалы •С2Н5, которые, в свою очередь, разрушают молекулы хлора, образуя новые радикалы. То есть происходит своего рода «цепная реакция».
5
Повышение температуры увеличивает скорость хлорирования этана. Однако поскольку также возрастает «выход» других хлорсодержащих производных этана, что нежелательно, эту реакцию проводят при низких температурах, для максимально возможного получения целевого продукта.
Полезный совет
Еще сравнительно недавно именно из этого вещества производился тетраэтилсвинец Pb(C2H5)4 - знаменитый ТЭЦ, присадка к моторному топливу, повышающая его октановое число и снижающая возможность детонации. Ввиду исключительной вредности этой присадки, из-за ядовитости свинца и всех его соединений, применение этилированных бензинов сейчас резко ограничено, а в ряде стран, вовсе запрещено. Разрешена лишь добавка ТЭЦ в авиационное топливо. Хлорэтан применяется также при производстве ацетилцеллюлозы, в кремнийорганическом синтезе, в качестве растворителя ряда смол, жиров и т.д. Он находит применение и в медицине, как быстродействующий анестетик при местном наркозе, «замораживатель».
Источники:
- из этана получить хлорэтан