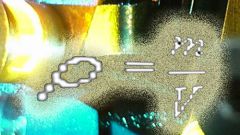Инструкция
1
Еще в 1811 году итальянским физиком А. Авогадро была установлена закономерность, которая рассматривалась только для идеальных газов:
pV= m/MRT
Теоретически это означает, что в равных объема х различных газов при одинаковых давлении и температурае находится одно и то же число молекул.
pV= m/MRT
Теоретически это означает, что в равных объема х различных газов при одинаковых давлении и температурае находится одно и то же число молекул.
2
Затем итальянский химик С. Канницаро рассмотрел этот закон с химической точки зрения, в основе которой лежит атомно-молекулярное учение. При этом, возникло следствие из закона Авогадро, который гласит, что при одинаковых условиях равное количество разных газов занимает равный объем. При нормальных условиях, т.е. при T =273,15 К, po =1,01325 *10^5 Па, один моль любого газа, независимо от его химического состава, занимает объем 22.4 л. Это и есть молярный объем газа, который может быть выражен следующим образом:
Vm = Vb/nb [л /моль]
Vm = 22,4 л/моль
Соответственно, nb =Vb/ Vm [л/(л/моль)]; выражение [л/(л/моль)] можно сократить, следовательно, вычисляемая по данной формуле величина измеряется в молях.
Vm = Vb/nb [л /моль]
Vm = 22,4 л/моль
Соответственно, nb =Vb/ Vm [л/(л/моль)]; выражение [л/(л/моль)] можно сократить, следовательно, вычисляемая по данной формуле величина измеряется в молях.
3
Молярный объем - величина постоянная и на ее основании могут быть определены объем газа и количество вещества. Обычно, если количество вещества известно, задача решается по формуле, представленной выше. Но как поступить, если известны лишь молярный объем, формула вещества и его масса? В этом случае, следует руководствоваться следующим:
При известной массе выходит, что nb=m/Mв-ва
Сначала следует найти молярную массу вещества, а затем, поделив массу на молярную массу получить его количество. Исходя из этого, уже может быть найден Vb, который равен:
Vb=Vm*nb=Vm*m/M
Преобразовав указанное выражение соответствующим образом, можно вычислить любую из фигурирующих в нем величин, при условии, что известны все остальные. Это позволяет решать с использованием данной формулы весьма широкий круг химических задач, встречающихся как в школьном или вузовском курсе химии, так и в повседневной практике профессионального химика-экспериментатора.
При известной массе выходит, что nb=m/Mв-ва
Сначала следует найти молярную массу вещества, а затем, поделив массу на молярную массу получить его количество. Исходя из этого, уже может быть найден Vb, который равен:
Vb=Vm*nb=Vm*m/M
Преобразовав указанное выражение соответствующим образом, можно вычислить любую из фигурирующих в нем величин, при условии, что известны все остальные. Это позволяет решать с использованием данной формулы весьма широкий круг химических задач, встречающихся как в школьном или вузовском курсе химии, так и в повседневной практике профессионального химика-экспериментатора.
Видео по теме